

Lưu
- Hóa Học
- Lớp 8
- 10 điểm
- takizawahayato -
cân bằng phương trình FexOy + CO ----> FeO +CO2 Làm cực chi tiết vào bài thi đấy
Hãy luôn nhớ cảm ơn và vote 5*
nếu câu trả lời hữu ích nhé!
TRẢ LỜI
Đây là câu trả lời đã được xác thực
Câu trả lời được xác thực chứa thông tin chính xác và đáng tin cậy, được xác nhận hoặc trả lời bởi các chuyên gia, giáo viên hàng đầu của chúng tôi.
Đáp án: Cách 1:
ta cân bằng Fe trước
Thấy có xFe ở vế trái nên ta đặt x ở FeO.
$Fe_xO_y+CO-->xFeO+CO_2\uparrow$
Lức đầu Fe giữ yO, nhưng sau pứ chỉ còn xO, như vậy oxit sắt đã bị lấy mất (y-x)O
Cứ 1 CO thì khử được 1 O của oxit sắt và tạo 1 $CO_2$
=>(y-x)CO thì khử được (y-x)O của oxit sắt và tạo ra (y-x)$CO_2$
Ta đặt y-x ở CO và $CO_2$
PTHH:
$Fe_xO_y+(y-x)CO -t°> xFeO+(y-x)CO_2$
Cách 2: bạn xem hình
Giải thích các bước giải:
Hãy giúp mọi người biết câu trả lời này thế nào?

518 vote
Bạn muốn hỏi điều gì?
Bảng tin
Bạn muốn hỏi điều gì?
 Inbox: m.me/hoidap247online
Inbox: m.me/hoidap247online Trụ sở: Tầng 7, Tòa Intracom, số 82 Dịch Vọng Hậu, Cầu Giấy, Hà Nội.
Trụ sở: Tầng 7, Tòa Intracom, số 82 Dịch Vọng Hậu, Cầu Giấy, Hà Nội.
Giấy phép thiết lập mạng xã hội trên mạng số 331/GP-BTTTT do Bộ Thông tin và Truyền thông.








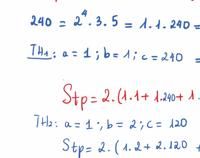





186
3571
163
Oke bạn,và theo mình thì cân bằng như trên là nhanh và dễ nhất đó ạ:)))
2
39
1
nhwung mik ko hiểu lắm
2
39
1
mik mói hok cô giáo mới dạy mik cách đặt a,b,c,d thôi
186
3571
163
Quan trọng là oxit sắt bị lấy mất bao nhiêu nguyên tử O, và có bao nhiêu nguyên tử CO lấy:)) mình sẽ đặt ẩn giúp bạn
186
3571
163
Oke
2
39
1
please
186
3571
163
Nếu bạn đặt thêm 1 ẩn ở $Fe_xO_y$ thì sẽ phức tạp hơn nhiều đấy ạ
52
1177
25
quá chi tiết